1 制備原料
活性炭幾乎可以用任何含炭材料來制造,煤炭、石油焦、木質素、塑料類等多種多樣的含碳材料均可用做制備活性炭的原料。由于煤炭資源儲量豐富、便宜易得,在相當長的一段時期內,煤炭資源是我國制備活性炭的主要原料。但是煤炭是一次能源,不可再生,隨著能源危機的加劇,使人們認識到可能再生資源的重要性,科研工作者利用棉花桿為原料化學活化法制備活性炭、利用竹子為原料磷酸為活化劑制備活性炭利用小麥秸稈為原料制備炭黑,還有研究者利用濕地水生植物為原料制備活性炭。
生物質資源是一種理想活性炭制備原料,它具有可再生、低污染、二氧化碳零排放等優點,同時價格較低、灰分少,且與煤炭資源相比,生物質資源形成時間短,結構疏松,具備天然的優勢,因此,在燃燒和熱解過程中具有自身的特點,易于形成發達的微孔,是制備活性炭的優良材料,是今后環境友好材料新技術應用的發展方向,值得進行深入研究。
生物質類資源的主要成分是纖維素、半纖維素和木質素。在熱解過程中會發生分子鍵斷裂、異構化和小分子聚合等復雜的熱化學反應。纖維素在52 °C時開始熱解,隨著溫度的升高,熱解反應速度加快,到350–370 °C生物質熱解分解為低分子產物;半纖維素結構上帶有支鏈,是木材中最不穩定的組分,比纖維素更易熱分解,溫度為225–325°C內分解,其熱解機理與纖維素基本相似。根據生成產物的不同,熱解過程可以分為干燥階段、預熱解階段、固體分解階段和煅燒階段:
(1)干燥階段:該階段溫度為120—150°C,生質中的水分開始揮發,其化學組成保持不變,為吸熱階段。
(2)預熱解階段:該階段的溫度為150~275 °C,生物質發生明顯的熱分解反應。其化學組成開始發生變化,內部結構發生重組,如脫水、斷鍵和自由基出現等,生物質中不穩定組分分解生成小分子化合物,如二氧化碳、一氧化碳和水等氣體。該階段也為吸熱反應階段。
(3)固體分解階段:該階段的溫度為275~475 °C,是熱解過程的主要階段,生物質各組分發生劇烈的解聚反應,分解成單體或單體衍生物并生成大量的分解產物;其中,液體產物中含有醋酸、木焦油和甲醇等,氣體產物中有CO2、CO、CH4和H2等,釋放出大量的熱量。
(4)焦炭分解階段:該階段的溫度為450~475 °C,得到的產物依靠外部供給的熱量繼續進行燃燒,C-O和C-H鍵進一步斷裂,釋放出揮發分,使其揮發性物質繼續減少,固定碳含量增加。上述的四個階段的反應過程會相互交叉進行,界限難以明確清楚劃分。
2.2活化方法
選擇合適的前體材料,精確控制炭化和活化工藝步驟,即可根據特定用途調整孔結構。活性炭制備活化方法包括物理活化法和化學活化法兩種,其不同之處在于制備過程中是否引入化學試劑。
物理活化法又稱為氣體活化法,即在973~1273 K下,水蒸氣、二氧化碳和氧氣等氧化性活化劑與炭化料活性點上的碳原子發生如下的水煤氣反應:

一般認為,碳和水發生水煤氣反應的過程機理如下:

其中,C*表示位于活性點上的碳原子,()表示處于吸附狀態。
由以上反應式可看出,由于部分碳原子被刻蝕,于是形成了更多的孔隙結構,從而具有較大的比表面積。由于沒有引入化學活化劑,物理活化法環境污染小,但是制備過程中,加熱溫度高且所需時間長,因此存在原料得率低,均勻性不好,產品吸附能力較小等缺點。
化學活化是制備活性炭廣泛使用的一種方法。化學活化法是先將原料粉碎后,把活化劑與原料按照一定比例混合均勻,根據活化劑的不同,可選擇性的在惰性氣氛保護下加熱,同步完成炭化和活化的一種方法。采用的活化劑主要有氯化鋅,磷酸、堿(如氫氧化鉀、氫氧化鈉)、堿金屬的碳酸鹽等。這些化學活化劑在炭化活化過程中所起的作用目前尚不明確,普遍認為活化劑一方面作為反應物參加與原料的化學反應;另一方面,活化劑的催化作用也很重要。盡管這些活化劑在活化過程中發揮的作用可能不同,但這些活化劑可降低活化溫度,具有的脫水作用可顯著降低炭化活化溫度。
ZnCl2法是最早的一種制備活性炭的化學活化方法,它的強脫水作用使木質素 炭化活化溫度顯著降低至150~300°C,并改變木質素熱分解過程,抑制焦油的生成,有利于孔隙的生成。氯化鋅與原料混合后,在較低溫度下(200°C)會使木質纖維素潤脹,并侵蝕到木質內部。由于ZnCl2沸點為732 °C,熔點為263 °C,在木質素炭化溫度下(450°C)呈液態存在,因此,ZnCl2在炭內均勻分布,當用水把氯化鋅洗滌去除后,就形成了發達的微細孔,但是制備過程中氯化鋅的揮發,易造成嚴重環境污染,很多國家已經禁止利用氯化鋅制備活性炭。
堿活化法是采用氫氧化鉀、氫氧化鈉等堿類物質,該方法最初主要是針對石油焦,但對其他如煤和果殼類作為前驅物生產活性炭也同樣有效。這種方法中將堿按照一定的混合比例加入到原料中,經研磨混合均勻后,在惰性氣體或者封閉系統加熱至700-800 °C炭化活化,能得到比表面積在3000 m2/g左右的具有大量籠狀微孔結構活性炭。堿法的活化機理,以KOH為例,可用以下反應方程式表示:
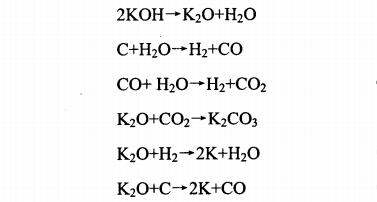
式中堿的脫水反應在500°C以下發生,水煤氣反應及水煤氣轉移反應,都是在氧化鉀作為催化劑下發生的反應。產生的二氧化碳與K2O固定為碳酸鹽,因此產生的氣體主要是氫氣、少量的CO、CO2、CH4和焦油等。一般認為,活化過程中消耗掉的碳主要生成了碳酸鉀,使產物具有較多的微孔結構㈨。氧化鉀繼續被氫氣或碳還原生成K單質,金屬鉀的沸點為762 °C,因此在800°C左右活化時,鉀單質的蒸氣不斷擠入碳原子所構成的層與層之間繼續活化炭料。雖然堿法是制備高比表面積活性炭常用的方法,但是炭化活化溫度較高,需要在惰性氣體保護下進行。除堿本身對設備的腐蝕性強、回收困難外,還存在活化溫度高、能量消耗大、生產成本高等缺點,因此實現大規模工業化生產還存在較多困難。
H3P04活化法是制備活性炭比較成熟的工藝,活化機理與氯化鋅法類似,能夠促進熱解反應過程,降低活化溫度,磷酸分布在原料內,占據了一定的位置,阻止了高溫條件下顆粒的收縮,避免了焦油的形成,洗滌除去磷酸鹽后,就可以得到具有發達孔隙結構的活性炭。磷酸活化法制備的產品孔徑分布較寬,中孔發達,應用范圍較廣。磷酸法對環境污染較小,炭化活化溫度低,與堿法相比對設備的要求相對較低,生產出的活性炭產品均勻穩定,沉降性能良好,可作為優良的液相吸附材料。目前,國內磷酸活化法制備木質活性炭研究重點是:(1)利用各種廢棄物為原料特別是以農業廢棄物如農產品加工過程中的廢渣、秸桿等為原料,制備出滿足不同應用需求的活性炭產品,同時實現廢棄物的綜合利用;(2)優化制備工藝參數,提高活性炭的質量,如添加催化劑、控制活化時間等;(3)嚴格控制生產過程中外來雜質的含量,以降低活性炭的灰分,如控制原料的雜質、降低水分的硬度和定期對循環磷酸進行處理。
3 加熱方法
常規加熱是在外部溫度梯度的推動下,經過熱源的傳導、媒介的熱傳遞、容器壁的熱傳導、樣品內部的熱傳導等過程來完成的。因此,常規加熱法存在能耗大、加熱效率低和加熱不均勻等缺點。微波是頻率為300MHz~3000GHz的電磁波。在加熱過程中,樣品內的極性分子吸收微波后做震蕩運動,分子之間的相互摩擦產生了熱量。與常規加熱方法相比,微波加熱具有許多優點:選擇性加熱、升溫速度快、加熱效率高、縮短加熱時間、降低能量消耗、受熱加熱均勻等。利用微波的加熱特性,可研發出在常規加熱條件下無法實現的新技術、新工藝和新產品,并實現加熱過程的高效、節能。目前微波加熱技術已經廣泛應用于家庭、環保、材料、冶金、化工、石油和國防等領域。
基于微波加熱的突出優勢,許多研究者利用微波加熱法制備活性炭。石河子大學的鄧輝課題組對于微波法制備活性炭開展研究,取得了一系列的成果。鄧輝,張根林等以棉桿為原料,磷酸為活化劑,通過微波加熱法制備活性炭,在輻射時間為8 min,輻射功率為400 W時可制備出比表面積為652.8 m2/g的活性炭產品。樊希安等以椰殼炭化料為原料,水蒸氣活化法,在微波加熱下制備顆粒活性炭,研究發現微波功率是影響活性炭性質的最大因素,最佳制備工藝條件為輻射功率為?700 W,輻射時間為3 min,所得活性炭具有發達的微孔結構,且微孔分別均勻,制備的活性炭得率為60.8%,碘吸附值為1031 mg/g,亞甲基藍吸附值為10.0 mL/0.1g,所需時間是傳統加熱方法的1/60,得率是傳統方法的2倍。







