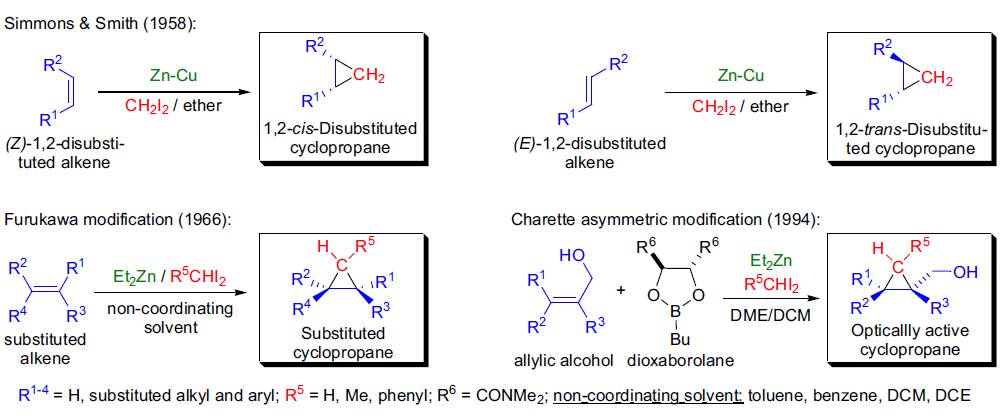
1958年,H.E. Simmons和R.D.Smith首次利用二碘甲烷和鋅銅偶(Zn-Cu)將無官能團烯烴(如環己烯,苯乙烯)具有立體選擇性地轉化為環丙烷。這一反應后來得到普遍使用,并且是一種非常高效的制備環丙烷的反應,此反應以發現者Howard EnsignSimmons, Jr.和R. D. Smith命名— Simmons-Smith環丙烷化反應。運用CH2I2-Zn對烯烴的環丙烷化的反應。在天然產物、合成化合物等具有生理活性以及醫藥品中大多存在環丙烷基團。即使是現在,開發高效的環丙烷化反應也是很有需求的。通常,該反應中使用的是鋅與銅或者銀做成的合金。有機鋅鹵化物和烯烴反應,通過游離的卡賓化合物得到環化產物。除了Zn,其他還有Et2Zn, Cu, R3Al, Sm(Hg)也能用于該反應,CH2N2-ZnI2體系的使用也有過報道,同時,相應的生成物的位置選擇性,立體選擇性也不盡相同。特別是,均一體系CH2I2-Et2Zn條件(古川法)的再現性非常好。一般的話,擁有給電子基團的烯烴的反應活性比較高。加入BF3等Lewis酸可以加速該反應,并且官能團的選擇性高,條件溫和,基本沒有副反應的產生。
此反應有如下特點:1)各種烯烴都可以參與反應:簡單烯烴,α,β-不飽和醛酮,富電子烯烴(烯醇醚,烯胺等等);2)由于試劑的親電子特性,富電子烯烴的環丙烷化的速度要快一些,但是,取代基較多的烯烴由于位阻較大也會減慢反應速度;3)環丙烷化具有立體選擇性,因此烯烴的立體化學構型保持;4)當取代亞甲基的試劑(R5≠H)與烯烴反應的時候,一般會生成順式立體構型的產物;5)手性底物參與反應的時候,環丙烷化有很高的非對映選擇性,反應一般在雙鍵位阻較小的一側進行;6)當烯烴含有雜原子官能團(e.g.,OH, OAc, OMe, OBn, NHR)的時候,這些官能團有很強的誘導效應,有機鋅試劑會在離官能團較近的一側進行反應;7)環狀烯醇參與反應時,立體化學結果和環大小有關:五、六、七元環具有很高的順式非對映選擇性,而更大的環一般得到是反式非對映選擇性的產物;8)此反應對大多數官能團有很好的耐受度;9)此反應一般使用非極性溶劑(e.g.,DCM, DCE),另外現在制備鋅銅偶也很方便(將鋅粉用硫酸銅溶液處理),但還有很多新開發的活性試劑:a)鋅銀偶,可以提高產率和反應速度;b)二乙基鋅和二碘甲烷的結果再現性很好(Furukawa改進);c)碘或氯甲基碘化釤(Sm/Hg/CH2I2)在多種雙鍵存在時對烯丙醇位的雙鍵具有很好的化學選擇性(Molander改進);d)二烴基(碘甲基)鋁(i-Bu3Al/CH2I2)在烯丙醇位雙鍵存在時對無官能團烯烴有很好的選擇性。
不對稱Simmons-Smith環丙基化反應可以通過以下方式實現:1)使用拆分的手性助劑(如,手性烯丙基醚,縮醛,硼酸酯);2)加入化學計量的手性添加物,如二烷氧基硼烷(由四甲基酒石酸二酰胺和正丁基硼酸制備(Charette 不對稱合成改進),但此方法只能用于烯丙醇的反應;3)使用手性催化劑,如手性磺酰胺配體(由反式-環己二胺制備),對于烯丙醇的反應可以得到很高ee值的產物。
反應機理
此反應是一個協同反應,過程中會生成一個雙三元環的蝶形中間體過渡態。這一機理得到了大量的反應的立體化學反應結果的驗證。


【J. Am. Chem. Soc.1994,116, 2651】
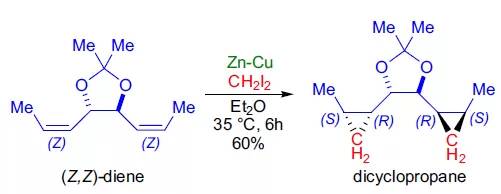
【Tetrahedron Lett. 1996, 37, 4397-4400】
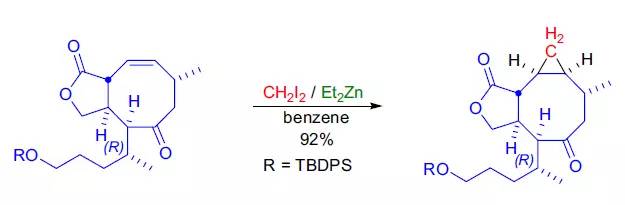
【J. Am. Chem. Soc. 1995, 117, 1455-1456】

【J. Am. Chem. Soc. 2001, 123, 10772-10773】

【J. Org. Chem. 2002, 67, 4501-4504】

【Bull. Soc. Chim. Fr. 1969, 3981-3990】
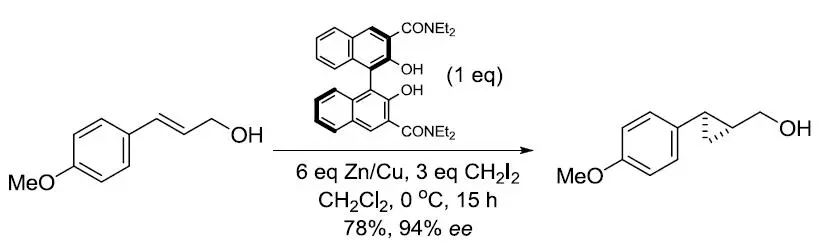
【Bull. Chem. Soc. Jpn. 1997, 70, 207-217】
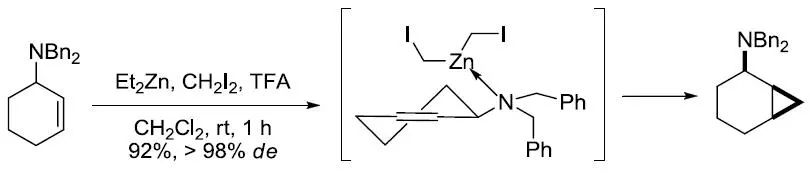
【Chem.Commun. 2007, 4029-4031】
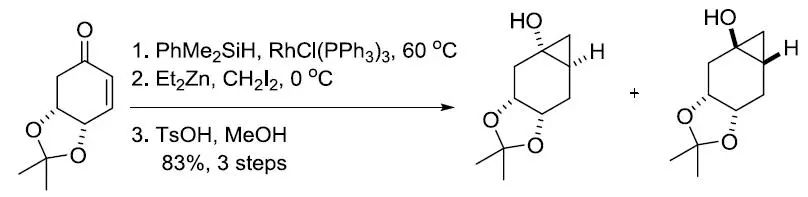
【Synthesis 2008, 3171-3179】

【Tetrahedron Lett. 2013, 54,147-150】







